| LA
SCHIUSA DELLE UOVA
Torna
all'indice
Preso atto che ricerche scientifiche sull'incubazione
artificiale delle uova di canarino
non credo esistano, si riporta di seguito il link alla
pagina internet sull'argomento ma riferito al pollame ... in
mancanza d'altro credo che sia sufficientemente
adattabile ....., e vista l'acclarata volatilità
delle pagine internet se ne riporta anche il testo.
unica
variante apportata al testo è stata l'aggiunta alla
tabella 7.7 della voce canarini.
http://www.vet.unipi.it/Dpa/mbagliac/schiusa/schiusa.htm
(link come previsto non più attivo)
|

|
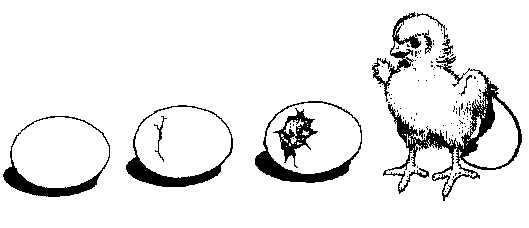
La nascita dei pulcini
guida per la gestione di un'esperienza di incubazione artificiale |

|
Marco Bagliacca (Professore Associato di Avicoltura)
Dipartimento Produzioni Animali, Facoltà di Medicina Veterinaria. Università di Pisa
|
|
|
Introduzione |
1. |
|
Dove trovare le uova fertili |
2. |
|
La conservazione delle uova |
3. |
|
Attenzioni generali |
3.1. |
|
Periodo di conservazione |
3.2. |
|
Temperatura e umidità |
3.3. |
|
Posizione delle uova |
3.4. |
|
Voltaggio delle uova |
3.5. |
|
Tabellina riassuntiva Conservazione |
3.6. |
|
L’incubazione |
4. |
|
Il giorno dell'incubazione |
4.1. |
|
La fase di incubazione |
4.2. |
|
Ventilazione, Temperatura e umidità dell'incubatrice |
4.3. |
|
La registrazione dei dati |
4.4. |
|
La speratura |
4.5. |
|
La fase di schiusa |
4.6. |
|
La nascita dei pulcini |
4.7. |
|
tabellina riassuntiva Incubazione |
4.8. |
|
Glossario |
5. |
|
Appendice |
6. |
|
Tabelle |
7. |
|
Periodo embrionale degli uccelli domestici |
7.1. |
|
Struttura semplificata di un uovo fertile |
7.2. |
|
Conversione da gradi Fahrenheit a gradi centigradi |
7.3. |
|
Scheda di incubazione |
7.4. |
|
Possibili cause di mancanza di schiusa delle uova |
7.5. |
|
Tabella psicrometrica (In gradi centigradi) |
7.6. |
|
Equivalenza dei periodi embrionali nelle specie più comuni |
7.7. |
|
Figure |
8. |
|
Struttura semplificata di un uovo fertile |
8.1. |
|
La perdita d’acqua e l’aumento della camera d’aria |
8.2. |
|
Lo psicrometro |
8.3. |
|
Indirizzi Utili |
9. |
|
Servizi pubblici di assistenza tecnica e professionale |
9.1. |
|
Incubatoi |
9.2. |
|
Produttori/venditori di incubatrici e attrezzature avicole |
9.3. |
|
Dove richiedere poster sullo sviluppo embrionale |
9.4. |
|
Libri che possono essere utili |
10. |
|
Versione e note |
11. |
1. Introduzione alla schiusa delle uova
Molti professori che insegnano materie nell’area scientifica si limitano alla spiegazione della teoria e tralasciano gli aspetti pratico applicativi non rendendosi conto che la seguente affermazione: "dimmelo e prima o poi lo dimenticherò, mostramelo e lo ricorderò, fammelo fare e non solo lo capirò ma lo saprò per sempre" è verissima.
Gli esperimenti scientifici che coinvolgono gli studenti sono scarsamente effettuati nelle scuole italiane e gli studenti, una volta all’università, sono spesso incapaci di gestire una ricerca scientifica che comporti aspetti pratico applicativi. La schiusa delle uova, l'esame degli embrioni che crescono e persino l'osservazione di un cuore che inizia a battere è una attività che sicuramente coinvolge tutti gli studenti e non verrà mai dimenticata.
Un'ampia varietà di uova e di embrioni può essere utilizzata per insegnare le basi scientifiche e i principi tecnici a tutti i tipi di studenti non solo dei licei ma anche delle scuole inferiori. Un esperienza condotta sullo sviluppo degli embrioni degli uccelli può essere la base per insegnare non solo lo sviluppo embrionale ma i principi di numerosi scienze: dalla nutrizione allo studio dell'apparato circolatorio, dall'igiene alla fisica della diffusione dei gas. Come dicono gli anglosassoni, per ultimo ma non in ultimo insegna agli studenti a misurare, raccogliere e analizzare i dati, in parole povere insegna il processo del progresso scientifico della conoscenza. La semplice effettuazione di questo progetto amplia enormemente la visone delle scienze, introduce concetti complessi in modo semplice e sviluppa un approccio intuitivo alle scienze biologiche. Questo tipo di esperienza che in passato era naturale per i molti studenti che vivevano nelle campagne, è oggi sempre più rara, specialmente per gli studenti che sono nati ed hanno sempre vissuto nelle città.
Questo manualetto vuole aiutare quindi l'insegnante di una classe che crede nel fatto che una sola esperienza insegna più dello studio di un libro e che il mondo reale "va toccato con mano". Il manuale contiene le informazioni complete necessarie per ottenere la schiusa in classe delle uova di gallina (o di un’altra specie avicola). Il manualetto descrive in dettaglio l'intero processo dall'ordinazione delle uova fertili al momento della nascita dei pulcini e include un glossario dei termini tecnici più comuni. Una lista di pubblicazioni scientifiche e di informazioni tecniche è riportata alla fine per ulteriori approfondimenti.
I lettori sono invitati a contattare l'autore per suggerimenti, commenti, domande e attività pratiche che possono fare da corollario all'incubazione.
L'indirizzo dell'autore con numero telefonico e E.mail è riportato alla fine del libretto.
2. Dove trovare le uova fertili
Il successo dell'esperienza presuppone l'utilizzo di uova fresche, pulite e fertili.
Le uova che si comprano nei supermercati non sono fertili. Le uova fertili possono essere acquistate dai moltissimi piccoli allevatori che allevano le galline a terra con uno o più galli ma molto spesso l'igiene di uova così prodotte è scarsa. Tali uova possono benissimo essere utilizzate quando vengono cotte (bollite o utilizzate per fare frittate) ma il loro impiego per l'incubazione da spesso scarsi risultati, così come il loro consumo "a crudo" espone a rischio sanitario il consumatore. Nel caso dell’incubazione si incuberebbero infatti uova più o meno contaminate da microrganismi e di scarsa qualità igienica che non schiuderanno e genereranno disappunto e frustrazione, sia negli studenti che nell'insegnante. L'impiego di uova provenienti da incubatoi commerciali assicura buona fertilità e igiene, anche se spesso alcuni incubatoi inviano malvolentieri piccoli quantitativi di uova. Il costo varierà in ragione della quantità che si acquista e della distanza dall'incubatoio. Una breve lista di incubatoi ai quali rivolgersi viene fornita alla fine del libretto. Le uova devono comunque essere fatte inviare per corriere o ritirate direttamente dall'incubatoio perché devono arrivare il giorno stesso della spedizione o al massimo il giorno successivo. Dovunque decidiate di rivolgervi ricordatevi di specificare che volete uova fertili per una esperienza di incubazione in una classe scolastica, questo perché anche le aziende italiane investono nel futuro.
3. La conservazione delle uova
Le uova fertili sono "vive" e la loro struttura è abbastanza complessa e delicata. Ogni volta che un uovo fertile è maneggiato impropriamente la sua "aspettativa di nascita" è diminuita. Per tale ragione, prima di essere poste nell'incubatrice, le uova fertili devono essere maneggiate come descritto nei paragrafi seguenti. Tutti i passi e le istruzioni devono essere seguiti con precisione per evitare il disappunto di una ridotta percentuale di schiusa o la nascita di pulcini non sani.
3.1. Attenzioni generali
Ricordare sempre che ogni uovo contiene delle cellule viventi quiescenti che devono trasformarsi in un pulcino sano e vitale. Fare molta attenzione a non arrecare danni al guscio delle uova. Un uovo incrinato schiuderà molto raramente e deve essere scartato per evitare che contamini le altre uova. Scartate anche le uova sporche. Se solo una piccola area del guscio dell'uovo è imbrattata di materiale fecale cercate di rimuovere lo sporco con un panno asciutto di carta del tipo "usa e getta". Non lavate mai le uova con l'acqua, potreste facilitare la penetrazione batterica del guscio e rimuovereste la pellicola batteriostatica invisibile (cuticola) che le protegge dalle contaminazioni.
3.2. Periodo di conservazione
La regola migliore è quella di mettere le uova nella incubatrice il prima possibile. Le uova che sono incubate entro sette giorni dalla loro deposizione, e non dalla spedizione, sono quelle che danno i risultati migliori. Ricordate però che un pulcino di gallina schiude dall'uovo dopo circa 21 giorni dall'inizio dell'incubazione. Nel caso di uova di gallina, ricordatevi di iniziare l'incubazione di martedì o mercoledì. In questo modo sarete sicuri che i pulcini nasceranno durante la settimana, quando ci sono le lezioni. In una schiusa c'è sempre qualche nascita che procede più rapidamente o più lentamente della norma e quindi gli studenti potranno vivere certamente l'esperienza di osservare una nascita "in diretta reale".
Qualora si scelga una specie diversa da quella del pollo, programmate l'incubazione basandovi sulla tabella dei tempi di incubazione per le altre specie riportata in fondo al manualetto.
3.3. Temperatura e umidità
Le uova fertili devono essere conservate ad una temperatura di 12°C - 20°C. Gli embrioni contenuti nelle uova cominciano a svilupparsi in modo anormale e malformato se la temperatura di conservazione è più alta. Se la temperatura è più bassa gli embrioni entreranno in dormienza profonda e molti moriranno. In ogni caso la schiusa diminuirà.
L'umidità relativa durante la conservazione deve essere approssimativamente del 75%. Quando le uova sono tenute in un ambiente eccessivamente umido si può formare della pericolosa condensa sulla superficie del guscio. La condensa crea una superficie di continuità dall'esterno all'interno delle uova facilitandone la contaminazione batterica. Se l'umidità è troppo bassa, viceversa, l’uovo si disidraterà eccessivamente e le membrane testacee (vedi schema semplificato di un uovo fertile in appendice) si seccheranno troppo con un conseguente aumento di mortalità embrionale. Durante la conservazione le uova devono perdere al massimo l’1% del loro peso iniziale.
3.4. Posizione delle uova
Se le uova vengono incubate entro dieci giorni dalla deposizione, conservarle in una scatola di cartone in posizione orizzontale o verticale utilizzando un portauovo, di plastica o cartone, con il polo ottuso  rivolto verso l'alto. rivolto verso l'alto.
Le uova vanno tenute con il polo ottuso  rivolto verso il basso quando si è costretti a conservarle per più di 10 giorni.
rivolto verso il basso quando si è costretti a conservarle per più di 10 giorni.
3.5. Voltaggio delle uova
Se le uova vengono conservate meno di una settimana dal momento che sono state deposte, non c'è nessun bisogno di voltarle. Se le uova vengono conservate più di 10 giorni dal momento che sono state deposte, devono essere voltate una volta al giorno.
Per voltare le uova durante la conservazione, mettete uno spessore (dei libri vanno benissimo) da un lato della scatola di cartone dove sono sistemate le uova in modo che la scatola risulti inclinata di almeno 45°. Il giorno successivo, togliete lo spessore da quel lato e mettetelo dal lato opposto, otterrete cosi una rotazione di 90° (2*45°).
3.6. Tabellina riassuntiva Conservazione
|
Temperatura: 15 -20° C |
|
- Umidità relativa 70 - 75% |
|
- girare le uova se la conservazione si protrae per più di sette giorni |
|
- incubare le uova di gallina il martedì o il mercoledì |
|
- maneggiare le uova con cura |
|
- non lavare mai le uova |
4. Incubazione
Preparare e regolare l'incubatrice almeno 2 o 3 giorni prima della prevista incubazione. Durante questo periodo potete regolare la temperatura e l'umidità senza per questo danneggiare le uova che non ci sono. Le regolazioni fatte mentre le uova sono già nell'incubatrice potranno abbreviare o allungare il periodo embrionale ma certamente diminuiranno la schiusa (l’aumento di temperatura accorcia il tempo di incubazione e viceversa). Se l'incubatrice è acquistata e munita di voltaggio automatico, controllare che questo funzioni correttamente. Scegliete un posto per l'incubatrice che sia protetto da correnti d'aria e non sia colpito direttamente dai raggi solari. Mantenete le condizioni dell'ambiente dove è localizzata l'incubatrice il più stabili possibile per tutto il periodo dell’incubazione. Non iniziate l'incubazione delle uova se non riuscite a raggiungere condizioni di temperatura e di umidità corrette e costanti all'interno dell'incubatrice.
4.1. Il giorno dell'incubazione
Se le uova sono state conservate in un frigorifero mantenetele a temperatura ambiente per almeno 2 - 4 ore prima di incubarle. Incubate le uova di gallina il martedì o il mercoledì se possibile. Prima di incubare le uova, numerate ciascun uovo con una matita (mai una penna o pennarello) e provvedete a pesare ciascun uovo. Nel caso di incubatrice auto costruita o priva di volta uova automatico, sempre con la matita, scrivete una "X" su un lato e una "O" sul lato opposto di ciascun uovo. Questi segni vi aiuteranno a controllare che le uova vengano girate mentre sono nell'incubatrice. Una volta che le uova sono state poste nell'incubatrice non regolate la temperatura per le successive 4 ore, a meno che questa non superi i 102,2°F (corrispondenti a 39°C). Dopo 4 ore effettuate gli aggiustamenti opportuni per avere una temperatura 99,5°F (corrispondente a 37.5°C) e una umidità del 52%. La temperatura di incubazione dovrebbe variare meno di 0,5°F in più o in meno rispetto alla temperatura ottimale, ricordando che 0,5° F sono pari a meno di ¼ di grado centigrado. La temperatura di una incubatrice di piccole dimensioni o auto costruita, sprovvista di circolazione forzata dell'aria, normalmente varia di più di quanto avviene in una incubatrice commerciale con ventilazione forzata. Tenete conto quindi che fino a che la temperatura non supera i 102,2° F (39° C) la schiusa non viene compromessa.
Nell'incubatrice il polo ottuso delle uova deve essere sempre più alto del polo acuto. L'embrione si orienta nell'uovo in modo tale che la testa si svilupperà in prossimità del polo ottuso dove è localizzata la camera d'aria. Se il polo acuto è più alto del polo ottuso la testa del futuro pulcino potrà orientarsi in modo diverso e l'embrione orientato in modo sbagliato non nascerà.
Nota: la temperatura è stata riportata sia in gradi fahrenheit che centigradi perché la maggior parte delle incubatrici commerciali impiegano la scala fahrenheit per la misurazione della temperatura. Pensando di fare cosa utile in appendice potete trovare una tabella di conversione da centigradi a fahrenheit oltre alla formule di conversione.
4.2. La fase di incubazione
Il periodo embrionale dei volatili viene generalmente suddiviso in due sotto periodi, la fase di incubazione e la fase di schiusa. Alla schiusa vengono generalmente assegnati gli ultimi 3 – 4 giorni della fase embrionale. Nel caso del pulcino di gallina, quando si parla di periodo di incubazione ci si riferisce ai primi 19 giorni dello sviluppo embrionale. I pulcini di gallina infatti nascono dopo 21 giorni di sviluppo embrionale: 19 giorni in "incubatrice" + 3 giorni in "camera di schiusa".
L’incubazione di uova di differenti specie nella stessa incubatrice non è mai da consigliare anche perché le diverse specie hanno periodi di embriogenesi differenti (vedi tabella in appendice).
Gli uccelli in natura voltano le uova frequentemente nel nido. Il voltaggio delle uova durante l'incubazione previene la morte degli embrioni e la nascita di pulcini malformati.
Il voltaggio manuale, che deve essere effettuato dagli studenti, crea un'atmosfera di attesa utilissima per l’apprendimento. Le uova devono essere voltate almeno 3 volte al giorno, anche se 5 volte sarebbe meglio (le incubatrici commerciali ruotano le uova una volta ogni ora). Il programma di voltaggio delle uova deve essere eseguito anche la domenica. Nel caso l'amministrazione della scuola non permetta l'accesso alla incubatrice durante la domenica, sarà necessario o acquistare una incubatrice automatizzata o munire l'incubatrice auto costruita di un volta uova automatico. L’operazione di voltaggio manuale non è una attività inutile e ripetitiva ma insegna la disciplina dell’allevamento degli animali, che non ha domeniche o feste comandate. Per questo motivo dovrebbe essere ben valutata la perdita di effetto didattico prima di optare per un’incubatrice automatica. Nel caso di voltaggio manuale è comunque necessario controllare che le uova vengano effettivamente ruotate dagli studenti. Indipendentemente dal numero delle volte che le uova vengono ruotate, è necessario controllare che nei giorni "pari" alla fine dell'orario delle lezioni rimanga visibile la "X" e nei giorni dispari la "O". Va enfatizzata l'importanza del fatto che gli studenti si devono sempre lavare le mani con il sapone e devono poi asciugarle con cura prima di toccare le uova. Le uova possono essere contaminate dai microrganismi durante l'incubazione e inoltre lo sporco può ostruire i pori presenti sul guscio. Ricordate anche che il polo ottuso deve essere sempre più alto del polo acuto e che l'operazione di voltaggio deve essere effettuata rapidamente dopo di che l'incubatrice va immediatamente richiusa per evitare abbassamenti di temperatura.
4.3. Ventilazione, Temperatura e umidità dell'incubatrice
L'embrione che si sta sviluppando dentro l’uovo consuma ossigeno ed emette anidride carbonica. La necessità di uno scambio gassoso è però molto ridotta all’inizio dell’incubazione e nel caso che nell’incubatrice vengano poste meno uova rispetto alla capienza della macchina. Nel caso di impiego di una incubatrice commerciale è necessario comunque seguire accuratamente le istruzioni della ditta produttrice per assicurare un adeguato scambio gassoso. Salvo indicazioni diverse riportate dal costruttore, la temperatura dell’incubatrice dovrebbe essere mantenuta a 99,5° F. Se la temperatura oscilla di più di 0,5°F rispetto a 99,5°F c’è da aspettarsi una bassa percentuale di schiusa. È indispensabile comunque controllare la temperatura almeno due volte al giorno annotandola sulla scheda di incubazione (vedi esempio in appendice). L’umidità relativa dovrebbe essere mantenuta intorno al 52% (corrispondente ad una temperatura del termometro bagnato di 84°F. La temperatura del termometro bagnato non dovrebbe oscillare più di 1-2°F durante il giorno.
Il controllo dell’umidità va comunque effettuato a cadenza settimanale valutando l’aumento della camera d’aria (personale esperto) o misurando il calo di peso delle uova (evaporazione) secondo lo schema riportato in appendice.
L’umidità relativa che misura il rapporto percentuale fra la quantità di acqua sotto forma di vapore dispersa nell’aria e la quantità massima che l’aria può contenere a quella temperatura (punto di saturazione), è estremamente importante per un corretto sviluppo dell’embrione. Per mantenere il corretto valore dell’umidità del termometro bagnato è necessario porre alla base dell’incubatrice una bacinella che deve essere giornalmente rifornita d’acqua.
La quantità di acqua aggiunta giornalmente dovrebbe essere registrata nella scheda di incubazione riportata in appendice. La regolazione dell’evaporazione si ottiene variando la superficie evaporante tramite l’impiego di coperchi più o meno grandi da porsi sulla bacinella.
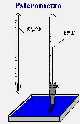
Qualora non fosse presente, è facile costruire uno strumento che misuri l’umidità dentro l’incubatrice. Per fare ciò sono necessari due normali termometri per misurare la temperatura ambientale, un pezzetto di filo inter dentale e un pezzetto di laccio da scarpe lungo circa 10 cm. Prima inserite il laccio da scarpe al quale avete tagliato la parte terminale, intorno al bulbo di uno dei due termometri poi, con il filo inter dentale legate il laccio da scarpe direttamente sopra il bulbo del termometro. Questo impedirà che il laccio si sfili dal termometro. Quindi mettete il lato opposto del laccio da scarpe direttamente dentro la vaschetta d’acqua. La lettura del termometro munito di laccio da scarpe vi darà la temperatura del termometro bagnato. La temperatura del termometro bagnato sarà sempre inferiore a quella del termometro asciutto a causa della perdita di calore dovuta all’evaporazione dell’acqua dal laccio di scarpe, che dipenderà oltre che dalla temperatura, dal vapore acqueo disperso nell’aria. Lo strumento che abbina i due termometri, asciutto e bagnato, si chiama psicrometro (vedi figura) e misura l’umidità relativa tramite la scala riportata in appendice.
4.4. La registrazione dei dati
Registrare giornalmente le condizioni ambientali dell’incubatrice e della stanza dove essa è sistemata. Una semplicissima scheda di incubazione è riportata in appendice. I dati raccolti possono essere utilizzati per insegnare le tecniche di misurazione, le serie temporali, lo studio di dati scientifici e persino semplici analisi statistiche.
La corretta registrazione dei dati non solo permette di porre immediata attenzione a problemi che possono ridurre la percentuale di schiusa ma la correlazione, anche solo grafica, dei risultati di più schiuse con i dati registrati permette di migliorare l’efficienza dell’incubazione. Non va mai dimenticato di enfatizzare che la rilevazione e la successiva elaborazione di dati sperimentali è alla base di tutti i progressi scientifici e tecnologici.
4.5. La speratura

Non tutte le uova schiuderanno. Molto probabilmente solo l’80% - 90% di esse sono fertili.
Rimuovere le uova che non sono fertili, o con embrione morto in epoca precoce, evita il disappunto di incubare uova che non potranno mai nascere e riduce una possibile fonte di contaminazione per l’incubatrice. Queste uova possono essere identificate tramite un operazione chiamata speratura. Questa operazione consiste nel far passare la luce attraverso il guscio delle uova per osservare lo sviluppo dell’embrione. Le uova a guscio bianco sono più facilmente sperabili di quelle con guscio colorato. Potete effettuare la speratura delle uova utilizzando uno spera uova commerciale o un normale proiettore da diapositive. Nel caso di utilizzo di un proiettore per diapositive è necessario prima costruire un cono di carta, con del cartoncino nero abbastanza spesso in modo tale che la luce non possa passare attraverso le pareti del cono, quindi tagliare la punta del cono in modo tale che il buco sia pari a circa ¼ del diametro delle uova che devono essere sperate. Mettete la base del cono sull’obiettivo del proiettore in modo che la luce passi solo attraverso il foro posto all’apice del cono. Oscurate la stanza e coprite con un uovo il foro posto all’apice del cono. Sarete in grado di vedere il contenuto dell’uovo. Esaminate le uova, maneggiandole con cura ed estraendole dall’incubatrice per breve tempo (massimo 10 minuti). Maneggiare le uova per brevi periodi durante l’incubazione non arreca danni allo sviluppo dell’embrione.
La presenza di un embrione vivo può essere facilmente confermata già dopo 8 – 10 giorni di incubazione. È visibile una rete capillare subito sotto il guscio delle uova e l’embrione appare come una macchia scura che diventa sempre più grande man mano che l’incubazione progredisce. Oltre una certo tempo è visibile solo una massa scura e la camera d’aria che diventa sempre più grande (vedi figura in appendice). Usate un uovo fresco, non fecondato, per osservare l’evoluzione della camera d’aria. Gettate direttamente nei rifiuti le uova chiare e quelle con l’embrione morto evidenziato dalla presenza dell’anello di sangue, dopo averle aperte per confermare l’osservazione fatta con la speratura. Se siete vicini ad un istituto zooprofilattico (gli indirizzi sono riportati in appendice) potete contattare preventivamente del personale specializzato che sarà in grado di effettuare una diagnosi delle cause di mortalità.
Al fine di individuare lo sviluppo embrionale normale dei pulcini in funzione dei giorni trascorsi dall'inizio dell'incubazione, può essere utile consultare la tabella che riporta l'equivalenza fra lo stesso stadio embrionale nelle più comuni specie avicole.
4.6. La fase di schiusa
Il periodo di tre giorni che precede la nascita dei pulcini viene definito schiusa. Le condizioni degli ultimi giorni che precedono la nascita sono molto diverse da quelle ottimali per il periodo precedente tanto che, a livello produttivo, esistono sempre due distinte macchine per l’incubazione e la schiusa delle uova: l’incubatrice vera e propria e la camera di schiusa. Dopo il diciottesimo giorno, le uova non vanno più ruotate. Se avete un volta uova automatico, rimuovetelo e ponete le uova su un panno o della cara (non di giornale) che metterete dentro la macchina. Questo fornirà ai pulcini una buona superficie per iniziare i primi passi. Assicuratevi che la carta o il panno non ostruiscano i buchi di aerazione o tocchino l’acqua o l’elemento riscaldante dell’incubatrice.
La temperatura deve essere mantenuta a 99,5°F (37,°C) e l’umidità deve essere almeno del 55% -60% ( pari a circa 86° – 88° F del termometro bagnato). Qualora l’umidità fosse troppo bassa, questa può essere aumentata mettendo nella vaschetta una spugna in modo da aumentare la superficie evaporante. Il ventunesimo giorno i pulcini devono iniziare a bucare il guscio delle uova.
4.7. La nascita dei pulcini
Il processo di schiusa richiede un grande sforzo da parte del pulcino. Si possono osservare periodi alternati di grande attività e di riposo. L’intero processo di fuoriuscita dall’uovo richiede mediamente 24 ore. Non vi preoccupate se un pulcino richiede più di 24 ore per uscire dall’uovo. Una volta che il pulcino è fuoriuscito completamente dall’uovo, questo deve rimanere per ulteriori 24 ore nell’incubatrice per asciugarsi. Lasciare i pulcini nell’incubatrice per almeno 24 ore dopo la schiusa permette loro non solo di asciugarsi completamente ma anche di riposarsi dallo sforzo della nascita. È necessario comunque aumentare l’areazione dell’incubatrice al fine di assicurare un sufficiente apporto di ossigeno. Quando tutti i pulcini sono nati abbassate la temperatura a 95°F (35°C).
Le uova che non si sono aperte alla fine del ventiduesimo giorno dall’inizio dell’incubazione devono essere gettate o esaminate per la diagnosi delle cause di mortalità. Non cercate di aiutare un pulcino ad uscire dal guscio. I pulcini malati o deformati devono essere fatti uccidere dagli studenti in modo rapido e il più possibilmente indolore perché soffrirebbero a lungo e morirebbero comunque. A tale scopo si può utilizzare una scatola di cartone preventivamente foderata con del nastro adesivo plastico e con all’interno un batuffolo di cotone imbevuto di etere. L’operazione può essere oggetto di una scientifica, e non solo emotiva, discussione sull’etica dell’allevamento.
Non preoccupatevi di fornire da mangiare ai pulcini. I pulcini dopo la nascita devono ancora finire di assorbire il tuorlo dell’uovo. Il tuorlo è infatti più che sufficiente a nutrire i pulcini per i due, tre giorni seguenti la loro schiusa.
4.8. Tabellina riassuntiva Incubazione
|
Focalizzare bene questi punti importanti per raggiungere buone percentuali di schiusa |
- Localizzare l’incubatrice in una stanza riscaldata, a temperatura costante, lontana da correnti d’aria.
|
- Incubare solo uova della stessa specie o con lo stesso periodo embrionale.
|
- Tenere una scheda di incubazione da riempire giornalmente.
|
- Controllare la temperatura dell’incubatrice giornalmente: T = 99,5° F (37,5° C).
|
- Controllare che la vaschetta dell’incubatrice contenga sempre acqua.
|
- Lavarsi e asciugarsi sempre le mani prima di maneggiare le uova.
|
- Tenere lontani dalle uova germi, sporco e unto.
|
- Ruotare le uova tre o cinque volte al giorno durante la fase di incubazione (i primi diciotto giorni nel caso di uova di gallina).
|
- Posizionare sempre il polo ottuso più in alto del polo acuto.
|
- Non girare le uova durante la fase di schiusa (ultimi tre giorni nel caso di uova di gallina).
|
- Prima della schiusa porre della carta o della stoffa sul ripiano dove cammineranno i pulcini.
|
5. Glossario:
Uovo fertile – uovo contenente un embrione vitale (allo stadio di blastula secondaria = circa 50.000 cellule) visibile sulla superficie del tuorlo come un puntino del diametro di 2-3 mm costituito da un anello circolare opaco che circonda un’area traslucida.
Uovo chiaro (vedi figura) - uovo che alla speratura, effettuata dopo 4-5 giorni di incubazione, non mostra alcuna struttura embrionale ed appare come un uovo non incubato. Può essere realmente non fertile o con un embrione morto in età molto precoce. (Le mortalità embrionali precoci e/o precocissime possono essere individuate solo con l'esame diretto, anche microscopico, della superficie del tuorlo)
Cuticola - Prima barriera alla penetrazione dei microrganismi. È formata dal muco vaginale che si secca. È invisibile a occhio nudo(vedi schema semplificato uovo).
Schiusa - numero di pulcini nati diviso numero di uova incubate; può essere espresso come tasso da 0 a 1 o come percentuale da 0 a100. Il valore massimo, che si realizza negli incubatoi industriali, è del 88%.
Camera d’aria - bolla d’aria localizzata sotto il polo ottuso delle uova fra le due membrane testacee. Il pulcino infila il becco in tale cavità al ventesimo giorno, quando comincia la respirazione polmonare (vedi schema semplificato uovo).
Anello di sangue (vedi figura) - un anello scuro visibile alla speratura sulla superficie del tuorlo determinato dalla morte dell’embrione durante i primi quattro giorni di incubazione.
Speratura - esame non distruttivo di un uovo tramite una luce molto intensa che permette di osservarne l’interno (esempio di speratura di uova di fagiano vedi figura).
Portauovo - supporto di plastica o cartone che viene inserito nei grandi imballaggi (scatole da trasporto) disegnato per contenere 30 uova (6*5).
Poro – canale di comunicazione che attraversa il guscio calcareo il cui diametro (10-20 µm) è sufficiente per il passaggio dei microrganismi
6. APPENDICE
7. Tabelle
Tabella 7.1. - Periodo embrionale degli uccelli domestici.
|
specie |
giorni |
|
Struzzo |
42-45 |
|
anatra muschiata (o muta) |
33-35 |
|
oca |
29-31 |
|
anatra comune |
27-28 |
|
Tacchina |
28 |
|
faraona |
26-27 |
|
Fagiana |
23-25 |
|
Pernice – starna |
22-24 |
|
Gallina |
21 |
|
Picciona |
16-18 |
|
Quaglia |
16-18 |
Tabella 7.2. - Struttura semplificata di un uovo fertile.
|
Cuticola - Prima barriera alla penetrazione dei microrganismi. È formata dal muco vaginale che si secca. È invisibile a occhio nudo. |
|
Guscio - Composto principalmente di CaCO3. Il colore dipende dal genotipo della gallina. Sono presenti dei pori, da 7000 a 15000, che sono concentrati al polo ottuso. |
|
Membrane testacee - Due membrane che avvolgono tutto l’albume. Costituiscono la seconda barriera alla penetrazione dei microrganismi. Il loro distacco forma la camera d’aria. |
|
Camera d’aria - Bolla d’aria che si forma al polo ottuso. Si forma per la contrazione del contenuto dell’uovo dopo la deposizione. Aumenta di volume per evaporazione con l’invecchiamento dell’uovo. |
|
Albume liquido - Di consistenza liquida. In prossimità del guscio (albume liquido esterno) e in prossimità del tuorlo (albume liquido interno). |
|
Albume denso - Di consistenza gelatinosa. Principale fonte di riboflavina e proteine. Non é distinguibile dall’albume liquido nelle uova vecchie. |
|
Calaze - Zone di albume denso di aspetto simile a corde arrotolate. Mantengono il tuorlo in posizione centrale |
|
Tuorlo - Il colore giallo dipende da tipo e quantità dei pigmenti contenuti nel mangime. Principale fonte di vitamine, minerali e grassi e del 50% circa delle proteine. |
|
Disco germinativo - In uova fertili non incubate: stadio di gastrula precoce (circa 5000 cellule). |
|
Membrana vitellina - membrana che avvolge tutto il tuorlo. |
Tabella 7.3. - Conversione da gradi Fahrenheit (°F) a gradi centigradi Celsius (°C)
|
Temp.°F = 9/5*Temp.°C + 32 |
Temp.°C = (Temp.°F-32)*5/9 |
|
°F |
°C |
°F |
°C |
°F |
°C |
°F |
°C |
°F |
°C |
|
80 |
26.7 |
87 |
30.6 |
94 |
34.4 |
99 |
37.2 |
103 |
39.4 |
|
81 |
27.2 |
88 |
31.1 |
95 |
35.0 |
99.5 |
37.5 |
104 |
40.0 |
|
82 |
27.8 |
89 |
31.7 |
96 |
35.6 |
100 |
37.8 |
105 |
40.6 |
|
83 |
28.3 |
90 |
32.2 |
96.8 |
36.0 |
100.4 |
38.0 |
|
|
|
84 |
28.9 |
91 |
32.8 |
97 |
36.1 |
101 |
38.3 |
|
|
|
85 |
29.4 |
92 |
33.3 |
98 |
36.7 |
102 |
38.9 |
|
|
|
86 |
30.0 |
93 |
33.9 |
98.6 |
37.0 |
102.2 |
39.0 |
|
|
Tabella 7.4. - Scheda di incubazione.
Tabella 7.5. - Possibili cause di mancanza di schiusa delle uova
|
Problema osservato |
Causa possibile |
|
Uova che esplodono |
Incubazione di uova sporche |
|
Embrione che non si sviluppa |
Uova non fertili, conservazione prolungata a basse temperature, temperatura in fase di incubazione troppo alta o troppo bassa |
|
Anelli di sangue |
Conservazione prolungata, temperatura in fase di incubazione troppo alta o troppo bassa |
|
Embrioni morti nella seconda settimana |
temperatura in fase di incubazione troppo alta o troppo bassa, uova non voltate, saltuaria mancanza di elettricità |
|
Camera d'aria troppo grande (eccessiva perdita di peso) |
Uova fuori misura (troppo piccole), umidità troppo bassa durante la fase di incubazione |
|
Camera d'aria troppo piccola (ridotta perdita di peso) |
Uova fuori misura (troppo grandi), umidità troppo alta durante la fase di incubazione |
|
Pulcini che nascono in ritardo |
Uova grandi, vecchie, temperatura troppo bassa, umidità troppo alta |
|
Pulcini che nascono in anticipo |
Uova piccole, temperatura troppo alta, umidità troppo bassa |
|
Pulcini che muoiono prima di bucare l'uovo |
Uova non voltate durante la fase di incubazione, uova con guscio troppo sottile, errori di temperatura in fase di incubazione, temperatura troppo alta in fase di schiusa, umidità troppo alta o troppo bassa in fase di schiusa |
|
Tuorlo non riassorbito completamente |
Temperatura troppo bassa in fase di incubazione e umidità troppo alta in fase di schiusa |
|
Malformazioni agli arti inferiori |
Temperatura e umidità scorrette in fase di incubazione |
Tabella 7.6. – Tabella psicrometrica
|
Temperatura Termometro bagnato |
Gradi di differenza fra i due termometri
In gradi centigradi |
|
|
1/2 |
1 |
1 1/2 |
2 |
2 1/2 |
3 |
3 1/2 |
4 |
4 ½ |
5 |
5 1/2 |
6 |
|
25 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
70 |
68 |
65 |
63 |
59 |
|
26 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
71 |
68 |
65 |
63 |
59 |
|
27 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
71 |
68 |
65 |
63 |
59 |
|
28 |
96 |
92 |
88 |
84 |
81 |
77 |
74 |
72 |
69 |
66 |
63 |
60 |
|
29 |
97 |
92 |
88 |
84 |
81 |
77 |
74 |
72 |
69 |
66 |
63 |
60 |
|
30 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
69 |
66 |
64 |
61 |
|
31 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
69 |
66 |
64 |
61 |
|
32 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
64 |
62 |
|
33 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
65 |
63 |
|
34 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
65 |
62 |
|
35 |
97 |
93 |
89 |
85 |
82 |
78 |
75 |
72 |
70 |
67 |
65 |
62 |
|
36 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
66 |
63 |
|
37 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
66 |
63 |
|
38 |
98 |
94 |
90 |
86 |
83 |
79 |
76 |
73 |
71 |
68 |
66 |
63 |
Tabella 7.7. - Equivalenza di stadio embrionale fra le più comuni specie avicole.
|
Gallina
|
Canarini |
Picciona Quaglia |
Fagiana Pernice Starna |
Anatra comune |
Tacchina Faraona |
Oca |
Anatra muschiata (o muta) |
Struzzo |
|
1 |

|
0-1 |
|
|
1 |
1 |
1 |
1 |
|
|
2 |

|
1 |
|
|
2 |
2 |
2 |
2 |
|
|
3 |

|
1-2 |
|
|
3-4 |
3-4 |
3-4 |
3-4 |
|
|
4 |

|
2 |
|
|
5 |
5 |
5-6 |
5-6 |
|
|
5 |

|
2-3 |
|
|
6 |
6 |
6-7 |
7 |
|
|
6 |

|
3 |
|
|
7 |
7 |
8 |
8-9 |
|
|
7 |

|
3-4 |
|
|
8 |
8-9 |
9-10 |
10 |
|
|
8 |

|
4 |
|
|
9 |
9-10 |
11-12 |
11 |
|
|
9 |

|
4-5 |
|
|
10 |
11 |
12-13 |
12-13 |
|
|
10 |

|
5 |
|
|
11 |
12 |
13-14 |
13-14 |
|
|
11 |

|
5-6 |
|
|
12 |
13 |
15 |
15 |
|
|
12 |

|
7 |
|
|
13 |
14 |
16 |
16-17 |
|
|
13 |

|
7-8 |
|
|
14-15 |
14-15 |
16-17 |
18-19 |
|
|
14 |

|
9 |
|
|
16 |
16 |
18-19 |
20 |
|
|
15 |

|
9-10 |
|
|
17-18 |
17-18 |
20-21 |
21-22 |
|
|
16 |

|
11 |
|
|
18-19 |
18-19 |
21-22 |
23-24 |
|
|
17 |

|
11-12 |
|
|
19-20 |
19-20 |
22-23 |
24-25 |
|
|
18 |

|
12-13 |
|
|
21-22 |
21-22 |
24-25 |
26-28 |
|
|
19 |

|
13 |
|
|
23-24 |
23-24 |
26-27 |
28-30 |
|
|
20 |

|
14 |
|
|
25-26 |
25-26 |
27-28 |
31-33 |
|
|
21 |

|
15 |
16-18 |
23-25 |
27-28 |
26-28 |
29-31 |
34-35 |
42-45 |
8. Figure
|
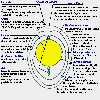
Figura 8.1.- Struttura semplificata di un uovo fertile |
|
Figura 8.2. – La perdita d’acqua e l’aumento della camera d’aria |
|
Figura 8.3. – Lo psicrometro |
|
|
|

|
|
|
|
|
|
Il corretto aumento della camera d’aria che si valuta con la speratura o si misura con il calo di peso delle uova serve per valutare la correttezza dell’umidità dell’incubatrice |
|
Per costruire uno psicrometro è sufficiente disporre di due normali termometri, un laccio da scarpe e un po’ di filo inter dentale |
9. INDIRIZZI UTILI
9.1. Servizi pubblici di assistenza tecnica e professionale
Prof. Marco Bagliacca PISA - Dipartimento Produzioni Animali, Facoltà di Medicina Veterinaria. V.le Piagge, 2 56100 Pisa. Tel. 050-570595, fax 050-540315. e.mail: mbagliac@vet.unipi.it. http://www.vet.unipi.it/biodata.htm.
Prof. Paolo Mani PISA - Dipartimento Patologia Animale, Facoltà di Medicina Veterinaria. V.le Piagge, 2 56100. Tel. 050-570310, fax 050-540644 e.mail: pmani@vet.unipi.it. http://www.vet.unipi.it/docenti.htm.
Istituti Zooprofilattici Lazio- Toscana:
Sede Centrale. Zooprofilattico ROMA. Dott. Gianluca Autorino - via Appia Nuova, 1411 00178 Capannelle ROMA. Tel. 06-790991-79099400)
Zooprofilattico AREZZO. Dott. Palarchi Mario - via U. della Faggiola, 14 52100 Arezzo. Tel. 0575-22263
Zooprofilattico FIRENZE. Dott. Giovanni Salvi - via di Castelpulci 50010 San Martino alla Palma (FI). Tel. 055-72138.
Zooprofilattico GROSSETO. Dott Alberigo Nardi - v.le Europa, 30 58100 Grosseto. Tel. 0564-456249.
Zooprofilattico PISA. Dott. Riccardo Forletta - via Lucchese, 2 56100 Pisa. Tel. 050-553563.
Zooprofilattico PISTOIA. Dott. Simonetta Stefanelli - via dei Macelli, 11 51100 Pistoia. Tel. 0573-367392.
zooprofilattico RIETI. Dott. Stefano BILEI - via Tancia, 21 02100 Rieti. Tel. 0746-201642.
Zooprofilattico SIENA Dott. Giovanni Salvi - v.le Toselli, 12 53100 Siena. Tel. 0577-41352.
Zooprofilattico VITERBO Dott. Luigi De Grossi - strada Terme 01100 Viterbo. Tel. 0761-250147.
Zooprofilattico LATINA Dott. Renato CONDOLEO - via Aniene, 1 04100 Latina. Tel 0773.479817.
Istituti Zooprofilattici – Piemonte - Liguria – Valle D’Aosta:
Sede Centrale. zooprofilattico TORINO. Prof. Giulio Cantini Collerizzi. Via Bologna,148 10154 Torino. Tel 011-26861, fax 2487770
Istituti Zooprofilattici – Lombardia – Emilia - Romagna:
Sede Centrale. zooprofilattico BRESCIA prof. Ezio Lodetti Via A.Bianchi,7 25124 Brescia. Tel 030-22901, fax. 225613-2425251.
Istituti Zooprofilattici – TRE Venezie:
Sede Centrale. zooprofilattico PADOVA Via Romea, 14/A 35020 Legnaro (PD). Tel 049-8830380.
Istituti Zooprofilattici - Umbria - Marche:
Sede Centrale. zooprofilattico PERUGIA. Dott. Guido Petracca Via G.Salvemini, 1 06100 Perugia. Tel 075-3431, fax 35047.
Istituti Zooprofilattici - Abruzzo - Molise:
Sede Centrale. zooprofilattico TERAMO Campo Boario 64100 Teramo. Tel 0861-3321, fax 332251.
Istituti Zooprofilattici - Puglia - Basilicata:
Sede Centrale. zooprofilattico FOGGIA. Dott. Doriano Chiocco via Manfredonia, 20 71100 Foggia. Tel. 0881-786111, fax 786362.
Istituti Zooprofilattici - Mezzogiorno:
Sede Centrale. zooprofilattico NAPOLI. Dott. Mario Luini Via Salute, 2 80055 Portici (NA). Tel 081-7865111-7753588, fax 7763125.
Istituti Zooprofilattici - Sicilia:
Sede Centrale. Zooprofilattico PALERMO. Dott. Santo Caracappa Via Rocco Dicilio, 4 90129 Palermo. Tel. 091-6565111, fax. 6670803.
Istituti Zooprofilattici - Sardegna:
Sede Centrale. zooprofilattico SASSARI. Dott. Guido Leori Via Duca degli Abruzzi, 8 07100 SASSARI. Tel 079-289200, fax 272189.
9.2. Dove ottenere uova fertili
omesso vedere
il link originario
9.3. Produttori e venditori di incubatrici e attrezzature avicole accessorie
omesso vedere
il link originario
9.4. Dove richiedere i poster sullo sviluppo embrionale
Hatching egg selection - Petersime nv Centrumstraat 125 B-9870 Zulte, Belgium. Tel 0032-91-889611, fax 888458.
How to identify infertile eggs and early-dead embryos. Dept of Poultry Husbandry. University of California Davis. 95616 CA. USA
Development of the Turkey embryo. Nicholas Turkey Breeding Farms, inc. 19449 Riverside Drive. Savanna, California 95476 CA USA
Poster POULTRY EMBRYO DEVELOPMENT. Indirizzo da inserire
10. Libri che possono essere utili per la corretta gestione dell’incubazione
Scientifici in italiano
Tecnologie Avicole. Giavarini I. (1988) – Edagricole (BO). ISBN: 88-206-2857-0. (tel. 06-42881098-42881222, Fax. 42827240. E.mail av@edagricole.agriline.it http://195.103.218.201:80/edagri/
Tecnici in italiano
Guida alla conduzione degli incubatoi. The Cobb Breeding Company East Hannningfield, Chlmsford, Essex CM3 8BY, Gran Bretagna tel.0044-245-400109 fax 0044-245-401099 marketing@cobb.demon.co.uk
In altre lingue europee
Inglese
Principles of Poultry Science. Rose S.P. (1997) – CAB International. ISBN: 0-85199-122-X. (tel. 0044-1491-832111, fax 833508, e.mail cabi@cabi.org)
Reproduction in Poultry. Etches R.J. 1996) - – CAB International. ISBN: 0-85198-738-9. (tel. 0044-1491-832111, fax 833508, e.mail cabi@cabi.org)
Francese
Reproduction des volailles et production d’oeufs. Sauveur B. (1988) – INRA Paris ISBN: 2-85340-961-9.
Spagnolo
Manual Pratico de Avicoltura. Castello Llobet J.A. e Gondolbeu V.S. (1986) - Real Esquela Oficial Y superior de Avicoltura Barcelona. ISBN: 84-600-4600-1.
Tedesco
Riferimento da inserire
Portoghese
Riferimento da inserire
11. NOTE
|
Le informazioni date in questo manualetto sono al solo scopo della effettuazione della esperienza descritta. I necessari riferimenti a ditte avicole, di produzione o commercializzazione, è fatto al solo scopo di facilitare il reperimento delle attrezzature. Gli utilizzatori del manualetto sono invitati a contattare l’autore per segnalare eventuali disservizi o ampliare e aggiornare l’elenco delle ditte al fine di evitare di tralasciare indirizzi utili. Nessuna remunerazione è prevista per tale collaborazione. Il prof. Bagliacca si impegna ad aggiornare annualmente il manualetto e rendendolo disponibile a tutti al seguente indirizzo telematico:
http://www.vet.unipi.it/~mbagliac/schiusa.htm. |
|
Gli utilizzatori sono incoraggiati a fotocopiare e distribuire anche solo parti del presente manualetto senza essere obbligati a citarne la fonte |
|
Versione del
23 Marzo 1998 |
Torna
all'indice |